| Numéro |
Le Nouveau Praticien Vét canine & féline
Volume 20, Numéro 86, 2023
Diabète
|
|
|---|---|---|
| Page(s) | 16 - 23 | |
| Section | Dossier : Diabète sucré chez le chien et le chat – 2e partie | |
| DOI | https://doi.org/10.1051/npvcafe/2024016 | |
| Publié en ligne | 21 juin 2024 | |
Traitement du diabète sucré : à part l’insuline ?
Treatment of Diabetes Mellitus: Beside Insulin?
EnvA, 7 avenue du Général de Gaulle 94700 Maisons-Alfort
L’apport d’insuline exogène et la prise en charge alimentaire constituent les principaux piliers du traitement du diabète sucré chez le chien et le chat. Néanmoins, malgré une prise en charge multimodale, certains individus présentent un mauvais contrôle glycémique. Cet article discute les alternatives aux traitements insuliniques lors de diabète sucré.
L’insulinothérapie ne constitue pas le seul pilier de la prise en charge du diabète sucré chez le chien ou le chat. L’alimentation, entre autres, participe grandement au contrôle de la glycémie. Une restriction en glucide améliore le contrôle de la glycémie et les chances de rémission. Malgré des prises en charge exhaustives et multimodales, certains individus continuent d’avoir un mauvais contrôle de leur diabète. Dans ces cas, une comorbidité doit être recherchée et l’obésité doit être prise en compte comme cause d’insulinorésistance secondaire à la glucotoxicité. Enfin, à l’inverse du chien, lors de diabète sucré chez le chat, une synthèse d’insuline endogène persiste souvent et permet l’utilisation d’exénatide afin de limiter la variabilité glycémique ou d’hypoglycémiants oraux lorsque l’observance du traitement injectable est mauvaise. Les hypoglycémiants oraux historiques ont une efficacité moindre, mais une nouvelle classe thérapeutique (les inhibiteurs du cotransport sodium-glucose de type 2) semble prometteuse.
Abstract
Insulin therapy is not the sole cornerstone in the management of diabetes mellitus in dogs or cats. Nutrition, among other factors, plays a significant role in glycemic control. Carbohydrate restriction improves glycemic control and the likelihood of remission.
Despite comprehensive and multimodal management, some individuals still exhibit poor control of their diabetes. In such cases, possible comorbidities should be investigated, and obesity should be considered as a cause of insulin resistance secondary to glucotoxicity.
Finally, unlike in dogs, in feline diabetes mellitus, there is often persistent endogenous insulin synthesis, allowing the use of exenatide to limit glycemic variability or oral hypoglycemic agents when compliance with injectable treatment is poor. Historical oral hypoglycemic agents have lower efficacy, but a new therapeutic class (sodium-glucose co-transporter 2 inhibitors) appears promising.
Mots clés : diabète sucré / alimentation / variabilité glycémique / exénatide / comorbidité / obésité / inhibiteur du SGLT2 / glipizide
Key words: Diabetes mellitus / diet / glycemic variability / exenatide / comorbidities / overweight / SGLT2 inhibitors / glipizide
Crédit Formation Continue : 0,05 CFC par article

Paul Remmel

Maxime Kurtz
© EDP Sciences, 2024
Objectifs pédagogiques
Souligner l’importance de rechercher et de traiter les comorbidités (y compris l’obésité) lors de diabète non équilibré.
Proposer des traitements adjuvants à l’insuline afin d’améliorer le contrôle de la glycémie.
Proposer des alternatives à l’insulinothérapie chez le chat lorsqu’un traitement par voie injectable n’est pas réalisable.
Essentiels
En plus de l’alimentation et de l’insulinothérapie, la prise en charge des comorbidités a un rôle essentiel dans la gestion du diabète sucré. Les maladies endocriniennes mais aussi toute maladie concomitante et l’obésité, peuvent être à l’origine d’une insulinorésistance dont le seul traitement peut suffir à équilibrer le diabète sucré.
Le concept de variabilité glycémique rencontre un intérêt croissant en diabétologie. Ce terme fait référence à la magnitude des variations du glucose au sein de la même journée ou d’un jour à l’autre. Une variabilité glycémique importante pourrait participer au mauvais contrôle du diabète, indépendamment de la glycémie moyenne. Sa prise en charge spécifique peut être indiquée dans certains cas.
L’exénatide injectable constitue une option thérapeutique pouvant participer à la réduction de la variabilité glycémique chez le chat diabétique.
La metformine, le glipizide et l’acarbose sont des hypoglycémiants oraux dont l’efficacité reste faible à modérée et dépend de la synthèse résiduelle d’insuline endogène.
Les inhibiteurs du cotransporteur sodium-glucose de type 2 (gliflozines) constituent une classe thérapeutique émergente et prometteuse lors de diabète sucré chez le chat.
L’adhérence du propriétaire à la démarche thérapeutique lors de diabète sucré constitue un point de friction indéniable dans la prise en charge de cette maladie. La nécessité d’injecter de l’insuline deux fois par jour peut avoir un impact négatif sur les qualités de vie du détenteur comme de l’animal. L’insulinothérapie exogène implique un suivi régulier et couteux : elle peut ainsi motiver des décisions d’euthanasie à la suite du diagnostic ou au cours du suivi au long terme [1]. La littérature vétérinaire fait état de l’utilisation de classes thérapeutiques non insuliniques, anciennes ou très récentes, présentant pour certaines l’avantage d’une possibilité d’administration orale. De plus, ces traitements sont associés à un moindre risque d’hypoglycémie iatrogène et à moins de risque de favoriser une prise de poids [2]. Certains de ces traitements peuvent être utilisés en tant que thérapie seule, ou doivent être prescrits conjointement à une insulinothérapie, principalement dans l’objectif d’améliorer le contrôle de la glycémie.
Optimisation du conträle glycémique lors de diabète sucré : tout ne repose pas toujours sur l’insulinothérapie !
Les objectifs du traitement du diabète sucré sont la résolution des signes cliniques, l’éviction des complications telles que l’hypoglycémie ou le diabète acidocétosique et le retour à une bonne qualité de vie tant pour le propriétaire que pour son animal [3]. Chez le chat, la rémission est décrite dans 15 à 100 % des cas selon les études, et se caractérise par le maintien de l’euglycémie malgré l’arrêt de l’insulinothérapie. Les avantages évidents qu’une rémission diabétique apporte au propriétaire (tant sur le plan financier que sur celui de la qualité de vie) et à l’animal en font également un objectif thérapeutique important pour cette espèce [4].
La glucotoxicité joue un rôle majeur dans la pathogenèse du diabète sucré félin. Ce terme fait référence à l’épuisement des cellules E du pancréas lors d’hyperglycémie persistante, qui conduit à une baisse de la production d’insuline. Ce phénomène, auto-entretenu et auto-aggravant, a l’avantage d’offrir une possibilité de réversibilité lors de diabète sucré chez le chat [5]. Ainsi, le maintien de la glycémie dans l’intervalle cible thérapeutique participe, non seulement, au contrôle des signes cliniques liés à l’hyperglycémie, mais aussi limite la glucotoxicité et augmente ainsi les chances de rémission [6,7]. De ce fait, l’administration quotidienne d’insuline reste le principal levier pour atteindre l’objectif de la rémission diabétique. L’alimentation participe également de manière significative au succès thérapeutique. Son importance est décrite dans un article de ce même numéro (« Recommandations nutritionnelles lors de diabète sucré chez le chien et le chat », de G. Blanchard).
Néanmoins, et malgré une prise en charge multimodale a priori complète, certains individus continuent de présenter des signes cliniques qui témoignent d’un diabète non équilibré. Il est alors fréquent et naturel que le vétérinaire présuppose que l’optimisation thérapeutique passe nécessairement par une modification de l’insulinothérapie. Toutefois, cette dernière ne constitue pas systématiquement le plus pertinent pour obtenir une réponse clinique satisfaisante : la prise en charge de maladies intercurrentes ou l’utilisation de traitements adjuvants à l’insulinothérapie est parfois indiquée. Cet article décrit et discute ces deux derniers points.
Par ailleurs, des alternances de phrases d’hyper- et d’hypoglycémies peuvent expliquer la persistance des symptômes malgré une glycémie moyenne (et donc une fructosaminémie) apparaissant dans l’intervalle cible thérapeutique. L’utilisation croissante d’appareils de mesure continue du glucose (tels que le dispositif FreeStyle Libre) permet aujourd’hui d’objectiver ces variations de la glycémie d’un jour à l’autre ou au sein d’une même journée. Ces excursions définissent la variabilité glycémique (Figure 1), qui est une notion nouvellement utilisée en médecine vétérinaire : elle peut être quantifiée par plusieurs indicateurs numériques, mais renseigne dans tous les cas sur la fréquence, la gravité et la rapidité des fluctuations de la glycémie au cours de la journée ou d’une journée à l’autre. Une variabilité glycémique forte semble être associée à un moins bon contrôle du diabète et, chez le chat, à de plus faibles chances de rémission [8,9]. Les causes de forte variabilité glycémique sont multiples : elles peuvent être intrinsèques à l’animal ou dépendre des modalités de prise en charge thérapeutique du diabète sucré (Tableau 1). Dans ce deuxième cas, elles peuvent être prises en charge par la mise en place d’un traitement adjuvant. Cet article discute également ces points.
 |
Figure 1 Valeurs de glycémie obtenues pendant 14 jours consécutifs et représentées selon les heures de la journée. Les médianes et écarts types à une heure donnée sont calculés à partir des valeurs de glycémie mesurées à cette heure pour les 14 jours de port du FreeStyle. L’épaisseur importante des bandes bleues entre 8 et 10 heures traduit un écart type important, et donc une dispersion importante des valeurs de glycémie en comparaison à la courbe de la glycémie médiane. Ceci illustre la notion variabilité de la glycémie. (© Paul Remmel) |
Enfin, certains propriétaires ne souhaitent pas ou ne sont pas en mesure d’administrer un traitement à base d’insuline injectable à leur animal diabétique. Cet article explore également des alternatives thérapeutiques à l’insuline, incluant des approches anciennes ainsi que des méthodes plus récentes, en discutant attentivement leurs chances d’efficacité.
Prise en charge des maladies intercurrentes : un point parfois crucial pour stabiliser le diabète sucré
La présence d’une maladie concomitante ou d’une obésité constituent des causes fréquemment associées à un défaut de contrôle du diabète sucré. Parfois, la prise en charge de ces facteurs est la seule intervention nécessaire pour améliorer le contrôle du diabète, sans qu’il soit nécessaire de modifier l’insulinothérapie.
En effet, en plus des maladies endocriniennes communément associées au diabète sucré telles que l’hypersomatotropisme (principalement rencontré chez le chat) ou l’hypercorticisme (rencontré plus fréquemment chez le chien), toute maladie concomitante peut être à l’origine d’une insulinorésistance. La prise en charge spécifique des affections intercurrentes ne constitue toutefois pas l’objectif de ce manuscrit et le lecteur est renvoyé vers l’article de M. Ménard « L’insulinorésistance : causes et prise en charge chez le chien et le chat » de ce même numéro.
L’obésité doit être considérée comme une maladie intercurrente à part entière lors de la prise en charge du diabète sucré (Photo 1). En effet, le tissu adipeux synthétise des adipokines, telles que la leptine, qui réduisent la sensibilité périphérique à l’insuline. Chez un individu sain, cette résistance à l’insuline est compensée par une augmentation de la production d’insuline endogène, mais chez l’individu diabétique, l’incapacité du pancréas à répondre à la demande croissante d’insuline conduit à l’installation d’une hyperglycémie chronique. L’obésité participe également à un état inflammatoire systémique subclinique qui contribue à l’insulinorésistance. La prise en charge du surpoids permet d’améliorer la sensibilité périphérique à l’insuline, optimisant la régulation glycémique par un pancréas aux capacités de synthèse pourtant réduites [11].
 |
Photo 1 Le surpoids et la sédentarité constituent des facteurs de risque importants à la survenue d’un diabète sucré chez le chat. (© Maxime Kurtz) |
La prise en charge de l’obésité est particulièrement importante dans l’espèce féline où, comme cité plus haut, l’insulinorésistance périphérique joue un rôle central dans la diabétogenèse. Chez le chien, les mécanismes conduisant au diabète sont différents : ils reposent de façon principale sur une diminution absolue des capacités de synthèse en insuline endogène, liée à une destruction progressive (possiblement immuno-médiée) des cellules E pancréatiques. Toutefois, dans cette espèce, l’obésité peut également favoriser l’insulinorésistance et participer au mauvais contrôle du diabète : sa prise en charge reste donc importante [12].
Ainsi, si la normalisation de la masse maigre reste un objectif clé de la prise en charge du patient diabétique ayant perdu du poids, une prise en charge spécifique visant à la perte de poids est toute aussi importante chez les individus obèses à la présentation [13]. Il est à noter que dans les deux espèces, le surpoids risque de s’aggraver après initiation de l’insulinothérapie en raison des effets anaboliques de cette dernière.
Nécessité d’un apport d’insuline exogène : l’inégalité des espèces
Si chez le chat, à l’inverse du chien, la persistance d’une capacité de synthèse d’insuline résiduelle complexifie la prise en charge du diabète sucré, elle offre également des possibilités thérapeutiques intéressantes et spécifiques à cette espèce :
d’une part, elle ouvre la porte à l’utilisation de stratégies pharmacologiques ayant comme objectif de stabiliser le diabète sucré en stimulant la synthèse d’insuline endogène : il s’agit principalement des incrétines et du glipizide,
d’autre part, la persistance d’une sécrétion d’insuline endogène permet de limiter le risque de l’évolution vers un diabète acidocétosique lorsque des traitements non insuliniques sont utilisés.
Nous insistons auprès du lecteur sur le fait que cette situation n’est pas similaire chez le chien : dans cette espèce en effet, la majorité des cas de diabète sucré est caractérisée par une abolition complète de la capacité de synthèse d’insuline. La prise en charge repose donc impérativement sur l’administration d’insuline exogène, sans quoi l’évolution vers un diabète acidocétosique est inévitable. Par conséquent, la suite de cet article portant sur les traitements alternatifs à l’insuline se focalisera exclusivement sur le chat.
Les incrétines : un traitement adjuvant à l’insuline
Physiologie et analogues des incrétines
La famille des incrétines désigne des hormones digestives comprenant principalement le Glucagon-Like-Peptide 1 (GLP-1) et le Glucose-Dependent Insulinotropic Polypeptide (GIP). Elles sont majoritairement sécrétées par des cellules épithéliales de l’intestin après le passage du bol alimentaire. Des peptidases (dipeptidyl peptidase-4 et endopeptidase neutre-24.11) sont responsables de leur dégradation rapide dans le sang, expliquant leur courte demi-vie.
Les incrétines amplifient la sécrétion d’insuline par le pancréas en réponse à un stimulus hyperglycémique [14]. Chez l’individu sain, et à stimulus glucosé intraveineux équivalent, la sécrétion d’insuline est majorée de 30 à 70 % lors de traitement préalable à base d’incrétine. Les autres effets de ces hormones sont nombreux et sont présentés dans la Figure 2. Entre autres, elles favorisent la multiplication des cellules E du pancréas. Les effets sur la synthèse de glucagon et la satiété varient selon le type d’incrétine. Le GLP-1, principale incrétine d’intérêt dans le cadre de la prise en charge du diabète sucré, réduit la synthèse de glucagon, la vidange gastrique et favorise la satiété. Ces actions, associées à la stimulation de la production d’insuline après passage du bol alimentaire, contribuent à limiter les hyperglycémies postprandiales et les variations de la glycémie sur la journée.
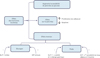 |
Figure 2 Effets des hormones incrétines : certains effets sont communs, d’autres sont opposés entre le GLP-1 et le GIP. (© Paul Remmel) |
Rôles émergents lors de diabète sucré
En raison de ses interactions nombreuses avec le métabolisme du pancréas endocrine, la voie des incrétines peut constituer une cible thérapeutique lors de diabète sucré. Notamment, l’utilisation d’analogues du GLP-1 résistants aux peptidases tels que l’exénatide ou le liraglutide a été récemment décrite chez le chat. Associée à une alimentation adéquate et à une insulinothérapie, l’administration d’exénatide s’accompagnait d’une réduction du besoin en insuline exogène et d’une glycémie moyenne plus basse, en comparaison aux animaux recevant un placébo [15]. Par ailleurs, l’administration d’exénatide favorise la satiété, ralentit la vidange gastrique et est associée à une perte de poids plus importante en comparaison à une insulinothérapie isolée [15,16].
À ce stade des connaissances, les indications claires de la prescription d’exénatide en complément de l’insulinothérapie ne sont pas déterminées chez le chat. Toutefois, ce traitement trouve probablement son intérêt principal dans la prise en charge de l’individu présentant une variabilité glycémique importante. En effet, dans une étude récente, l’administration d’exénatide était associée à une réduction significative de la variabilité glycémique en comparaison à une insulinothérapie seule [8]. Il est à noter que, dans cette même étude, les chats recevant un traitement à base d’exénatide présentaient également une probabilité de rémission plus importante que ceux recevant uniquement une insulinothérapie.
En pratique, l’exénatide est utilisé sous la forme d’une préparation injectable de longue action, administrée une fois par semaine à la dose de 200 μg/kg par voie sous-cutanée. Au moment de la rédaction de cet article, le principal médicament à base d’exénatide en France (Bydureon®*) n’est plus disponible à la délivrance, mais il est possible que le recours à d’autres spécialités à base d’incrétines se développe à l’avenir. Les effets secondaires sont modérés et comptent surtout des troubles digestifs ou des diminutions d’appétit transitoires [17]. Son effet inhibiteur sur la production de glucagon s’interrompt lors d’euglycémie, limitant le risque d’hypoglycémie [8,15,16].
Puisqu’il exerce son action sur les cellules E du pancréas, l’exénatide requiert une capacité de synthèse d’insuline endogène résiduelle. Il apparaît impossible de préjuger du stade d’évolution de la maladie au moment de la présentation initiale. Ainsi, lors d’utilisation d’un traitement à base d’incrétines, il est impossible de déterminer la capacité résiduelle de synthèse d’insuline et donc de prédire le succès thérapeutique. L’intérêt de l’exénatide chez le chat n’a pas été évalué, mais semble limité pour les raisons expliquées précédemment dans cet article.
En sus de l’administration d’incrétines exogènes, la demi-vie des incrétines endogènes peut être augmentée par l’utilisation d’inhibiteurs des peptidases (sitagliptine) : ces axes thérapeutiques restent peu explorés en médecine vétérinaire. Enfin, en raison de son effet stimulant sur la synthèse de glucagon et la prise de poids, les analogues du GIP ne sont pas utilisés.
Traitements en remplacement de l’insuline
L’ensemble des modalités de prise en charge précédemment citées nécessitent la poursuite d’injections quotidiennes ou hebdomadaires d’insuline : ceci n’est pas toujours souhaité ou réalisable par les propriétaires. De ce fait, la possibilité de traitements oraux a depuis longtemps été explorée, en particulier chez le chat. Si, de façon historique, la majorité de ces traitements semble présenter une efficacité limitée, la littérature vétérinaire rapporte l’utilisation de nouvelles classes thérapeutiques prometteuses.
Inhibiteurs de type 2 du cotransporteur sodium-glucose rénal
Cette classe thérapeutique a récemment fait son entrée dans le monde vétérinaire avec deux principes actifs : la bexagliflozine, principalement disponible en Amérique du Nord, et la velagliflozine disponible depuis peu en France.
Après filtration par le glomérule rénal, le glucose est réabsorbé au niveau du tube contourné proximal (TCP). Le mécanisme (Figure 3) fait intervenir, entre autres, des cotransporteurs sodium-glucose ATP-dépendants : ce sont les canaux SGLT2. Les inhibiteurs des SGLT2 diminuent donc la réabsorption tubulaire du glucose et favorisent son excrétion urinaire, permettant de minorer l’hyperglycémie lors de diabète sucré [18]. Un article dans le prochain numéro (NPVcafe n° 87) détaillera les premières données d’efficacité et d’innocuité quant à son utilisation. Des études récentes [19,20] montrent qu’une administration orale en une prise quotidienne à la dose de 1 mg/kg est associée à une amélioration des signes cliniques liés au diabète sucré chez plus de deux tiers des animaux, dès une semaine après le début du traitement, et de façon durable. Dans une étude clinique européenne, l’administration de velagliflozine n’était pas inférieure en comparaison à une insuline porcine mixte, en termes de réduction de la gravité des signes cliniques, de contrôle biologique (évaluation de courbes de glycémie et de la fructosaminémie), et de qualité de vie. De plus, les gliflozines présentent l’avantage de ne pas être associées au risque d’hypoglycémie iatrogène clinique, un avantage incontestable en comparaison aux traitements à base d’insuline.
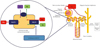 |
Figure 3 Mécanisme de réabsorption du glucose et fonctionnement des inhibiteurs SGLT2. Glu = Glucose ; Na = Sodium ; K = Potassium. (© Paul Remmel) |
L’amélioration clinique, en particulier la résolution de la polyuro-polydipsie, peut sembler paradoxale lors de l’utilisation d’une molécule dont le mode d’action repose sur une majoration de la glycosurie. Le principe thérapeutique repose sur le cercle vertueux lié à la pathogenèse diabétique particulière chez le chat, précédemment abordée dans cet article : en favorisant l’élimination rénale du glucose, la velagliflozine est associée à une diminution de la glycémie moyenne au cours de la journée. De ce fait, le phénomène de glucotoxicité (c’est-à-dire la réduction de la capacité de synthèse d’insuline par les cellules E des îlots de Langerhans, causée par une hyperglycémie chronique) est résolu : le pancréas retrouve une capacité de synthèse suffisante pour maintenir la glycémie dans un intervalle physiologique. Toutefois, il est important de comprendre qu’en l’absence d’une capacité de synthèse endogène résiduelle d’insuline, les gliflozines ne permettent pas de favoriser la disponibilité cellulaire du glucose. De ce fait, en cas d’utilisation de gliflozine chez un animal ne présentant plus de capacité de synthèse d’insuline endogène, il existe un risque d’évolution vers une acidocétose. Cette complication représente l’inconvénient principal de cette classe thérapeutique : elle semble survenir dans 10 à 15 % des cas [21], le plus souvent dans les deux semaines qui suivent l’initiation du traitement. Une particularité de cette forme d’acidocétose diabétique est qu’elle peut se déclarer malgré une glycémie comprise dans l’intervalle de référence ou discrètement élevée : on parle de diabète acidocétosique euglycémique [21].
En dehors de cette complication, la tolérance de ces traitements est plutôt bonne. Une diarrhée discrète, le plus souvent auto-résolutive, est fréquemment rapportées : elle est possiblement liée à un mécanisme osmotique consécutif à une inhibition des transporteurs du glucose de l’épithélium intestinal.
Hypoglycémiants oraux
La prescription d’hypoglycémiants oraux constitue un point central dans la prise en charge du diabète de type 2 chez l’Homme. En médecine vétérinaire féline, les traitements les plus fréquemment cités comprennent la metformine, le glipizide et les inhibiteurs de l’alpha-glucosidase (acarbose) qui agissent respectivement en améliorant la sensibilité périphérique à l’insuline, en stimulant la libération d’insuline par les cellules E résiduelles ou en réduisant l’absorption du glucose par le tube digestif.
Chez le chat, néanmoins, l’efficacité de ces molécules reste très modeste. Les données de littérature sont peu fournies, et le nombre d’animaux inclus dans les cohortes d’études est faible :
la metformine a été étudiée chez 5 chats diabétiques et n’a permis une amélioration clinique et biologique que chez 1 individu [22] ;
de même, l’acarbose ne semble pas améliorer le contrôle de la glycémie ou les chances de rémission lorsqu’il est associé à une insulinothérapie et à une alimentation adaptée, par comparaison au même traitement sans acarbose [23] ;
le glipizide, lui, est possiblement plus efficace et semble être associé à une amélioration du diabète dans 30 % des cas environ où il est utilisé. Il semble être associé à une rémission diabétique chez environ 12 % des chats traités [24].
Il est possible que l’efficacité réduite de ces hypoglycémiants oraux chez le chat, en comparaison aux données chez l’Homme, soit due à un diagnostic tardif du diabète sucré chez le premier avec des capacités résiduelles du pancréas déjà faibles.
Conclusion
L’insulinothérapie représente le pilier historique du traitement du diabète sucré chez le chien comme chez le chat, mais sa réussite dépend également de la prise en charge alimentaire, de la modulation de la sensibilité des tissus à l’insuline et, chez le chat, de la capacité résiduelle de synthèse d’insuline endogène d’origine pancréatique. Les traitements autres que l’insuline ont pour objectif d’agir sur ces éléments afin d’améliorer le contrôle du diabète.
Chez le chat, à l’inverse du chien, l’existence d’une synthèse résiduelle d’insuline endogène par le pancréas offre d’autres possibilités thérapeutiques prometteuses. L’exénatide peut être utilisé afin de limiter la variabilité glycémique et favoriser une perte de poids. De même, alors que les hypoglycémiants oraux historiques (glipizide, acarbose, metformine) étaient associés à une efficacité limitée, la classe des gliflozines semble prometteuse et pourrait se substituer à l’insulinothérapie chez certains chats.
Le présent manuscrit portait principalement sur l’approche thérapeutique du patient diabétique symptomatique. Il est possible, voire probable, que certaines des classes thérapeutiques décrites dans cet article puissent trouver un intérêt dans la prévention du risque de rechute après une rémission diabétique. Des études restent nécessaires pour investiguer ces hypothèses.
Liens d’intérêt
Les auteurs déclarent ne pas être en situation de lien d’intérêt en relation avec cet article.
Références
- Niessen SJM, Hazuchova K, Powney SL, Guitian J, Niessen APM, Pion PD, et al. The Big Pet Diabetes Survey: Perceived Frequency and Triggers for Euthanasia. Vet Sci. 2017;4(2):27. [PubMed] [Google Scholar]
- Glior C. Chapter 33 - Gastrointestinal hormones and the use of non-insulin therapies for diabetes mellitus. In: Feline Endocrinology, Feldman E, Fracassi E and Peterson M. 2019; p. 489–502. (Edra; vol. 1). [Google Scholar]
- European Society of Veterinary Endocrinolgy. ALIVE Project. Definition: treatment goals of diabetes mellitus 2021 [Internet]. [cité 5 nov 2023]. Disponible sur: https://www.esve.org/alive/search.aspx/ [Google Scholar]
- Fracassi F. Chapitre 32 : Insulin treatment of diabetes mellitus. In: Feline endocrinology - Feldman E, Fracassi F, Peterson M. Edra. Milano, Italie; 2019; p. 468–81. [Google Scholar]
- Gostelow R. Chapter 36: Diabetic remission. In: Feline endocrinology - Feldman E, Fracassi F, Peterson M. Edra. Minalo, Italy; 2019; p. 542–55. [Google Scholar]
- Nack R, DeClue AE. In cats with newly diagnosed diabetes mellitus, use of a near-euglycemic management paradigm improves remission rate over a traditional paradigm. Vet Q. 2014;34(3):132–6. [CrossRef] [PubMed] [Google Scholar]
- Hafner M, Dietiker-Moretti S, Kaufmann K, Mueller C, Lutz TA, Reusch CE, et al. Intensive intravenous infusion of insulin in diabetic cats. J Vet Intern Med. 2014;28(6):1753–9. [CrossRef] [Google Scholar]
- Krämer AL, Riederer A, Fracassi F, Boretti FS, Sieber-Ruckstuhl NS, Lutz TA, et al. Glycemic variability in newly diagnosed diabetic cats treated with the glucagon-like peptide-1 analogue exenatide extended release. J Vet Intern Med. 2020;34(6):2287–95. [CrossRef] [PubMed] [Google Scholar]
- Zini E, Salesov E, Dupont P, Moretto L, Contiero B, Lutz TA, et al. Glucose concentrations after insulin-induced hypoglycemia and glycemic variability in healthy and diabetic cats. J Vet Intern Med. 2018;32(3):978–85. [CrossRef] [PubMed] [Google Scholar]
- Reusch C., Salesov E. Chapter 35: Monitoring diabetes in cats. In: Feline endocrinology, Feldman E, Fracassi F, Peterson M. Edra. Milano, Italy; 2019; p. 522–41. [Google Scholar]
- Sallander M, Eliasson J, Hedhammar A. Prevalence and risk factors for the development of diabetes mellitus in Swedish cats. Acta Vet Scand. 2012;54(1):61. [CrossRef] [PubMed] [Google Scholar]
- Verkest KR, Rand JS, Fleeman LM, Morton JM. Spontaneously obese dogs exhibit greater postprandial glucose, triglyceride, and insulin concentrations than lean dogs. Domest Anim Endocrinol. 2012;42(2):103–12. [CrossRef] [PubMed] [Google Scholar]
- Behrend E, Holford A, Lathan P, Rucinsky R, Schulman R. 2018 AAHA Diabetes Management Guidelines for Dogs and Cats. J Am Anim Hosp Assoc. 2018;54(1):1–21. [CrossRef] [PubMed] [Google Scholar]
- Gilor C, Rudinsky AJ, Hall MJ. New Approaches to Feline Diabetes Mellitus: Glucagon-like peptide-1 analogs. J Feline Med Surg. 2016;18(9):733–43. [CrossRef] [PubMed] [Google Scholar]
- Scuderi MA, Ribeiro Petito M, Unniappan S, Waldner C, Mehain S, McMillian CJ, et al. Safety and efficacy assessment of a GLP-1 mimetic: insulin glargine combination for treatment of feline diabetes mellitus. Domest Anim Endocrinol. 2018;65:80–9. [CrossRef] [PubMed] [Google Scholar]
- Riederer A, Zini E, Salesov E, Fracassi F, Padrutt I, Macha K, et al. Effect of the Glucagon-like Peptide-1 Analogue Exenatide Extended Release in Cats with Newly Diagnosed Diabetes Mellitus. J Vet Intern Med. 2016;30(1):92–100. [CrossRef] [Google Scholar]
- Padrutt I, Lutz TA, Reusch CE, Zini E. Effects of the glucagon-like peptide-1 (GLP-1) analogues exenatide, exenatide extended-release, and of the dipeptidylpeptidase-4 (DPP-4) inhibitor sitagliptin on glucose metabolism in healthy cats. Res Vet Sci. 2015;99:23–9. [CrossRef] [PubMed] [Google Scholar]
- Hoenig M, Clark M, Schaeffer DJ, Reiche D. Effects of the sodium-glucose cotransporter 2 (SGLT2) inhibitor velagliflozin, a new drug with therapeutic potential to treat diabetes in cats. Journal of Veterinary Pharmacology and Therapeutics. 2018;41(2):266–73. [CrossRef] [PubMed] [Google Scholar]
- Behrend EN, Ward C, Chukwu V, Cook A, Kroh C, Lathan P, Schermerhorn T, Scott-Moncrieff JC, Voth R. Velagliflozin, an SGLT2 inhibitor, as once-daily, oral solution, stand-alone therapy for feline diabetes mellitus - 2023 ACVIM Forum Research Report Program. Journal of Veterinary Internal Medicine. 2023;37(6):2638–60. [CrossRef] [Google Scholar]
- Niessen S.J.M., Voth R, Kroh C, Hennings L. Once daily oral therapy for feline diabetes mellitus: SGLT-2-inhibitor velagliflozin as stand-alone therapy compared to insulin injection therapy in diabetic cats - Research Communications of the 32nd ECVIM-CA Online Congress. Journal of Veterinary Internal Medicine. 2022;36(6):2455–551. [CrossRef] [Google Scholar]
- Hadd MJ, Bienhoff SE, Little SE, Geller S, Ogne-Stevenson J, Dupree TJ, et al. Safety and effectiveness of the sodium-glucose cotransporter inhibitor bexagliflozin in cats newly diagnosed with diabetes mellitus. J Vet Intern Med. 2023;37(3):915–24. [CrossRef] [Google Scholar]
- Nelson R, Spann D, Elliott D, Brondos A, Vulliet R. Evaluation of the oral antihyperglycemic drug metformin in normal and diabetic cats. J Vet Intern Med. 2004;18(1):18–24. [CrossRef] [PubMed] [Google Scholar]
- Mazzaferro EM, Greco DS, Turner AS, Fettman MJ. Treatment of feline diabetes mellitus using an alpha-glucosidase inhibitor and a low-carbohydrate diet. J Feline Med Surg. 2003;5(3):183–9. [CrossRef] [PubMed] [Google Scholar]
- Feldman EC, Nelson RW, Feldman MS. Intensive 50-week evaluation of glipizide administration in 50 cats with previously untreated diabetes mellitus. J Am Vet Med Assoc. 1997;210(6):772–7. [CrossRef] [PubMed] [Google Scholar]
Tests de formation continue
L’obésité peut, à elle seule, participer à un mauvais équilibre du diabète : vrai/faux ?
Vrai
Faux
Des variations marquées de la glycémie d’un jour à l’autre ou au sein d’une même journée (variabilité glycémique) ne sont dues qu’à une durée d’action trop courte de l’insuline utilisée :
Vrai
Faux
L’exénatide agit principalement en :
Mimant l’activité du Glucose-Like-Peptide 1 (GLP-1).
Réduisant la variabilité glycémique chez les chats lors de diabète sucré.
Favorisant la perte de poids.
Toutes les réponses.
Les hypoglycémiants oraux peuvent être utilisés en thérapie isolée chez le chien :
Vrai
Faux
L’effet secondaire le plus redouté des inhibiteurs du cotransporteur sodium-glucose de type 2 est :
Une hypoglycémie clinique
Une diarrhée
Une anorexie
Une crise acidocétosique sans hyperglycémie
Liste des tableaux
Liste des figures
 |
Figure 1 Valeurs de glycémie obtenues pendant 14 jours consécutifs et représentées selon les heures de la journée. Les médianes et écarts types à une heure donnée sont calculés à partir des valeurs de glycémie mesurées à cette heure pour les 14 jours de port du FreeStyle. L’épaisseur importante des bandes bleues entre 8 et 10 heures traduit un écart type important, et donc une dispersion importante des valeurs de glycémie en comparaison à la courbe de la glycémie médiane. Ceci illustre la notion variabilité de la glycémie. (© Paul Remmel) |
| Dans le texte | |
 |
Photo 1 Le surpoids et la sédentarité constituent des facteurs de risque importants à la survenue d’un diabète sucré chez le chat. (© Maxime Kurtz) |
| Dans le texte | |
 |
Figure 2 Effets des hormones incrétines : certains effets sont communs, d’autres sont opposés entre le GLP-1 et le GIP. (© Paul Remmel) |
| Dans le texte | |
 |
Figure 3 Mécanisme de réabsorption du glucose et fonctionnement des inhibiteurs SGLT2. Glu = Glucose ; Na = Sodium ; K = Potassium. (© Paul Remmel) |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.


